Geassocieerde symptomen
Chronische ontstekingen
Concentratiestoornissen
Gevoel van uitputting (’s ochtends)
Hypertensie
Oedemen
Overgewicht en buikvet
Verhoogde spierspanning
Verhoogde stress gevoeligheid
Verlaagde pijndrempel
Verslechterd kortetermijn geheugen
Vertraagde of slechte wondgenezing
Geassocieerde ziektebeelden
Alle ontstekingsziekten
Autoimmuunziekten
Metabool syndroom
Onvruchtbaarheid
Premenstrueel syndroom
Syndroom van Cushing
Depressie
Kanker
Fibromyalgie
Uitsluitingscriteria van cortisolresistentie
Ontbreken buikvet
Onbekend met problemen om wakker te worden ’s morgens of ochtendvermoeidheid
Afwezigheid concentratiestroornissen
Geen wondgenezingsproblemen
Goed kortetermijn geheugen
Geen schrikachtig gedrag
Introductie
Iedere keer dat onze negen zintuigen gevaar signaleren wordt het stress systeem geactiveerd (1). Negen zintuigen (!?) zult u vast verbaasd denken. Afhankelijk van definitie kunnen we het volgende onderscheiden: We kennen de bekende zintuigen waarmee we van alles van buitenaf waarnemen, zoals reuk, smaak, zicht, gehoor en tast.
We hebben ook interne zintuigen, zoals het immuunsysteem dat bedreigingen door virussen en bacteriën in het lichaam kan signaleren en bestrijden. Daarbij het introceptieve systeem, dat potentieel gevaarlijke verandering in het lichaam waarneemt (bijv. de bloeddruk) en kan beschouwd worden als het zevende zintuig. Emoties (gevoelens) en gedachten kunnen een stressreactie uitlokken en kunnen beschouwd worden als het achtste en negende zintuig.
Stress (gesignaleerd via de zintuigen) is de reactie op (potentieel) gevaar en het lichaam zal er alles aan doen om schade te voorkomen en te overleven. Het kan heel goed zijn dat de reactie overmatig is of dat de reactie überhaupt niet eens nodig is. Ons lichaam volgt de logica: “better safe than sorry”, want de dood is einde verhaal.
Gevaar activeert een universele stressreactie
Continu zijn alle cellen in ons lichaam, afzonderlijk en gezamenlijk (weefsels, organen of het gehele lichaam) bezig met het in stand houden van homeostase, ofwel biologisch balans. Het afgaan van balans heet allostase, waarbij stress en ontsteking (inflammatie) ervoor is om weer in homeostase te komen.
De activering van het stresssysteem is een beschermingsreactie op zowel interne bedreigingen (bacteriën, virussen, enzovoorts) en externe bedreigingen (leeuw, lawaai, schulden, enzovoorts). Waarbij de volgorde van reacties altijd hetzelfde is (2).
Het lichaam maakt namelijk gebruik van twee stress-assen waarmee de door stress gevraagde verandering in gang wordt gezet. Centraal hierin staat de aanpassing c.q. verschuiving in de energieverdeling, ten gunste van de hersenen, de spieren en het hart. De stoffen die geproduceerd worden door de twee geactiveerde assen zijn noradrenaline en adrenaline (geproduceerd door het zogenaamde neurovegatatieve zenuwstelsel ook wel de sympathicus genoemd) en cortisol (het produkt van de HPA-as).
Met andere woorden: als een mens door een leeuw achterna wordt gezeten, zorgen deze stoffen ervoor dat er onmiddelijk energie naar de spieren, het hart en de hersenen gaat, zodat de mens allereerst het ‘juiste’ besluit uitvoert en dat is beweging (van de hartspier en de andere spieren). Dit doet het lichaam via bloeddruk en vaatverwijding of vernauwing. Hoe meer bloed, des te meer energie, zoals zuurstof en glucose bij de cellen op die plek aan kan komen. Deze complexe maar noodzakelijke stressrespons zorgt er dus voor dat er voldoende energie naar de organen gaat die het probleem moeten oplossen. Als het probleem opgelost is, moet normaliter de stressrespons ook weer stoppen. Alleen dan lopen andere organen niet de kans om verwaarloosd te worden, wegens o.a. een gebrek aan energie (ATP).
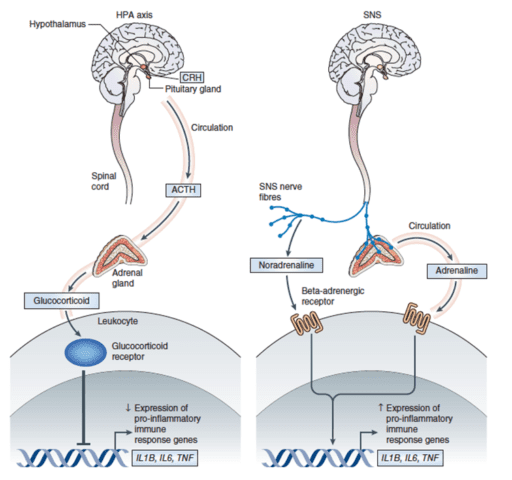
Illustratie uit wetenschappelijk bron: “(2012). Social neuroscience and health: neurophysiological mechanisms linking social ties with physical health” (3).
Het lichaam beschikt over twee stress-assen. De HPA-as dat cortisol produceert en de sympaticus (SNS) dat adrenaline en noradrenaline produceert. De stresshormonen adrenaline en noradrenaline zijn pro-inflammatoir en leidt tot (meer) onsteking. Cortisol is een stresshormoon met een anti-inflammatoir effect en functioneerd als buffer en beeindiger van de inflammatierespons. Let op: cortisol heeft ook pro-inflammatoire effecten.
Cortisolproductie, activatie, transport en resistentie
Cortisol (glucocorticoïd) wordt voornamelijk geproduceerd door de bijnierschors en ook door andere weefsels, maar met geringe hoeveelheden (4). Na vrijmaking van cortisol wordt het meeste daarvan getransporteerd door een eiwit dat cortisol bindt (cortisolbindende globuline) en door een bloedeiwit (albumine) (5). Slechts 5% van het geproduceerde cortisol is bioactief, terwijl de overige 95% als ‘gebufferde’ hoeveelheid aanwezig is en dient als reserve voor tijden van verhoogde behoefte (5). Iedere menselijke cel is cortisolgevoelig door de aanwezigheid van een zogenaamde glucocorticoidreceptor (GR). De GR is onder normale omstandigheden niet actief en wordt alleen door de aanwezigheid van cortisol geactiveerd. Dit gebeurt alleen als cortisol ook daadwerkelijk in de bioactieve vorm aanwezig is. Het blijkt namelijk dat cortisol omgezet kan worden in inactief corticosterone en vice versa.
Cortisolproductie via de HPA-as:
Aanzet tot cortisolproductie loopt dus vooral via de HPA-as. Zoals hierboven uitgelegd zal het brein via de zintuigen informatie verwerken en indien het als bedreigend wordt beschouwd, via verschillende tussenstations en hormonen in de bijnieren cortisol laten produceren. Als er een bepaalde hoeveelheid hormoon bij een tussenstation geproduceerd wordt, dan zorgt dat ook weer voor remming van de aanmaak van een ander hormoon (negatieve feedback) zodat er geen overreactie zal ontstaan (6).
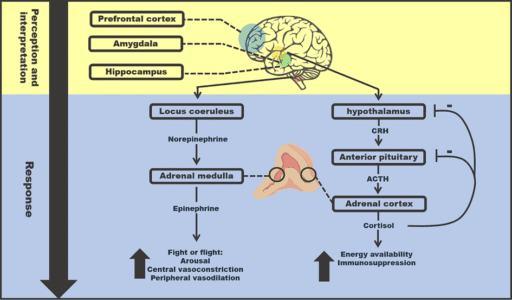
Illustratie uit wetenschappelijke bron: (2020) “Chronic stress and endothelial dysfunction: mechanisms, experimental challenges, and the way ahead” (6).
De reactie die optreedt door het waarnemen van stress via de hersenen is het resultaat van de gecombineerde invoer van 2 integrale systemen. Dit zijn de sympaticus en de hypothalamus-hypofyse-bijnier (HPA) as. Via het afgegeven cortisol door de bijnieren, wordt negatieve feedback gegeven aan aan de hypofyse en de hypothalamus, waardoor productie van cortisol verminderd.
Na productie van cortisol is dit cortisol verantwoordelijk voor het uitzetten van de HPA-as. Het immuunsyssteem is echter in staat is om de HPA-as uit te zetten bij langdurige activatie en dit gebeurt bijvoorbeeld bij langdurige ontsteking (>42 dagen). Daarnaast worden de bijnieren als gevolg van een langdurige prikkeling door ontstekingsstofen die het immuunsysteem produceert, steeds minder gevoelig daarvoor. Daardoor stoppen ze langzamerhand met de productie van cortisol. Dit is de reden en het mechanisme waarom we in eerste instantie, de gevolgen van stress niet ervaren.
In de medische literatuur wordt de uiteindelijke status van verminderde cortisolproductie door de bijnieren beschreven als uitputting van de bijnieren (7). Dit is echter een misvatting. Als de bijnieren werkelijk uitgeput zouden zijn tijdens het proces van chronische laaggradige ontsteking, dan zouden andere prikkels de bijnieren ook niet meer kunnen activeren. Niets is minder waar. Onderzoek heeft uitgewezen dat bepaalde (hormetische) prikkels de bijnieren probleemloos weer cortisol (adrenaline en noradrenaline) kunnen laten produceren (7,8). De bijnieren zijn dus niet uitgeput, maar ongevoelig (resistent) geworden onder andere voor ontstekingsstoffen van het immuunsysteem (9). Duurt dit te lang, dan is er nog zo weinig cortisol aanwezig dat het immuunsysteem ook daadwerkelijk niet meer ‘uitgezet’ kan worden.
Daardoor is het immuunsysteem dat toxische stoffen produceert, chronisch in de bloedbaan aanwezig en zal het lichaam over tijd steeds meer beschadigd raken. Dit is in een notendop het verhaal van cortisoltekort en –resistentie, dat we waarnemen bij mensen met langdurige laaggradige onsteking en zo goed als bij alle chronische aandoeningen (9,10,11).
Daarnaast moeten we echter nog een andere mechanisme bespreken. Namelijk de manier waarop het immuunsysteem zichzelf ongevoelig maakt voor cortisol, zodat het zichzelf blijvend kan activeren. Het immuunsysteem heeft namelijk een eigen manier om zichzelf corisol ongevoelig te maken (12). Daarvoor gebruikt het een enzym dat het actieve cortisol omzet in inactief corticosteron (11-beta steroid hydroxydehedydrogenase2). Dat is gunstig bij een acute infectie, omdat het immuunsysteem nu de tijd krijgt om allerlei bacteriën en andere ziekteverwekkers (pathogenen) te doden. Dit is echter ook de strategie die verantwoordelijk is voor langdurige activiteit, zodat cortisol het immuunsysteem dan niet meer kan uitzetten. Alle mogelijke stressbronnen kunnen daarbij aanleiding geven voor de (chronische) activatie van het immuunsysteem.
Samenvattend zijn de gevolgen van langdurige immuunactivatie:
1. HPA-as minder actief
2. Bijnieren eerst meer en daarna minder actief (minder cortisol)
3. Immuunsysteem cortisolresistent
Cortisol resistentie en verminderde wondgenezing
Het menselijk lichaam heeft vrijwel continu te maken met microbiële invasies, laesies en chemisch letsel. Dit moet opgelost, hersteld en genezen worden via ontstekingsmechanismen. Laaggradige ontsteking, cortisole deficientie en resistentie heeft hier in negatieve zin veel impact op. In het artikel herstel en wondgenezing is hier meer over te lezen.
Herstellen van het (cortisol)systeem en gezondheid
De oplossing in evolutionaire (kPNI) geneeskunde is altijd meervoudig en daarmee dus een combinatie van psychologie, voeding en zogenaamde hormetische prikkels. Aan de ene kant zijn deze nodig om het cortisolmechanisme te reguleren en daarmee het immuunsysteem tot rust te brengen. Aan de andere kant gaat het er om het immuunsysteem minder te belasten c.q. te prikkelen. Het heeft tweezijdig verband met elkaar.
De gevolgen van stress: Van baarmoeder tot alzheimer
Het levenscyclus-stress model van Lupien laat de gevolgen zien van chronische stress of extreme acute stress op verschillende fasen in een mensenleven (13). Deze stress uit zich in verstoorde cortisolwaarden in het bloed en weefsels, zowel (te) laag of (te) hoog.
In onderstaande illustratie is te zien hoe de hersencentra verschillende ontwikkelingssnelheden laten zien (de gekleurde balken) en verschillend reageren op cortisol. Stress voor de geboorte heeft op alle drie centra effecten bij de programmering voor het latere leven. Tot aan de leeftijd van twee jaar is vooral het kortetermijngeheugen (hippocampus) blootgesteld aan een versnelde ontwikkeling en is daardoor erg gevoelig voor stress. De soort en sterke van de stressoren zijn bepalend voor de reactie van de stress-as.
Misbruik vermindert de hormoonproductie. Veelvuldig gescheiden worden van de moeder verhoogt de stresshormoonspiegel bij peuter significant. Dit kan cortisolresistentie tot gevolg hebben. Kinderen hebben een instinctief verwachtingspatroon wat hun ouders betreft: nabijheid, bescherming, veiligheid en onvoorwaardelijke liefde. Als kinderen dat van hun ouders krijgen, dan kunnen ze zich optimaal ontwikkelen (2).
Stress vanaf de puberteit heeft vooral invloed op de emotionele centra (amygdala) en het lange termijngeheugen (frontale cortex). In de tweede levenshelft is het precies omgekeerd. De hippocampus ontwikkelt zich op kinderleeftijd het snelst en wordt na het dertigste jaar steeds kleiner. Overmatige stress versnelt dit proces.
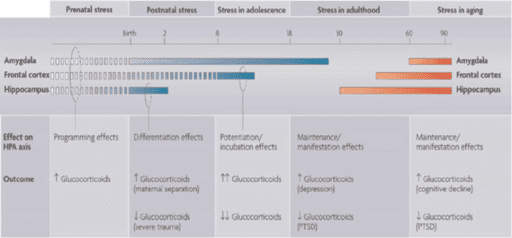
Illustratie en wetenschappelijk bron: Lupien et al (2009). A transdisciplinary perspective of chronic stress in relation to psychopathology throughout life span development (13).
Bepaalde hersengebied: amygdala, frontale cortex, hippocampus zijn (vooral) vatbaar voor verandering en functie, dat zich uit in psychopathology en veroorzaakt wordt door chronische en/of acute stress, dat afhankelijk is van levensfase.
Over de Auteur

Drs. Sjoerd Knobben, is psycholoog en klinische PsychoNeuroImmunologische therapeut, trainer in mindfulness, martial arts (o.a. Kung Fu) en voorzitter bestuur kPNI.nl. Alles komt samen in zijn praktijk voor zelf-actualisatie en gezondheid, Upotential.
Bronnen
Algemene bron en deel informatie komt uit: Pruimboom, L., & Reheis, D. (2019). Word weer mens (1ste editie). Alianza Editorial.
1 Matzinger P. (2002). The danger model: a renewed sense of self. Science (New York, N.Y.), 296(5566), 301–305. https://doi.org/10.1126/science.1071059
2 Segerstrom, S. C., & Miller, G. E. (2004). Psychological stress and the human immune system: a meta-analytic study of 30 years of inquiry. Psychological bulletin, 130(4), 601–630. https://doi.org/10.1037/0033-2909.130.4.601
3 Eisenberger, N. I., & Cole, S. W. (2012). Social neuroscience and health: neurophysiological mechanisms linking social ties with physical health. Nature neuroscience, 15(5), 669–674. https://doi.org/10.1038/nn.3086
4 Taves, M. D., Gomez-Sanchez, C. E., & Soma, K. K. (2011). Extra-adrenal glucocorticoids and mineralocorticoids: Evidence for local synthesis, regulation, and function. American Journal of Physiology-Endocrinology and Metabolism, 301(1). https://doi.org/10.1152/ajpendo.00100.2011
5 Cain, D. W., & Cidlowski, J. A. (2015). Specificity and sensitivity of glucocorticoid signaling in health and disease. Best practice & research. Clinical endocrinology & metabolism, 29(4), 545–556. https://doi.org/10.1016/j.beem.2015.04.007
6 Sher, L. D., Geddie, H., Olivier, L., Cairns, M., Truter, N., Beselaar, L., & Essop, M. F. (2020). Chronic stress and endothelial dysfunction: mechanisms, experimental challenges, and the way ahead. American journal of physiology. Heart and circulatory physiology, 319(2), H488–H506. https://doi.org/10.1152/ajpheart.00244.2020
7 Brooks, K., & Carter, J. (2013). Overtraining, Exercise, and Adrenal Insufficiency. Journal of novel physiotherapies, 3(125), 11717. https://doi.org/10.4172/2165-7025.1000125
8 Pruimboom, L., Ruiz-Núñez, B., Raison, C. L., & Muskiet, F. A. (2016). Influence of a 10-Day Mimic of Our Ancient Lifestyle on Anthropometrics and Parameters of Metabolism and Inflammation: The “Study of Origin”. BioMed research international, 2016, 6935123. https://doi.org/10.1155/2016/6935123
9 Straub, R. H., Cutolo, M., Buttgereit, F., & Pongratz, G. (2010). Energy regulation and neuroendocrine-immune control in chronic inflammatory diseases. Journal of internal medicine, 267(6), 543–560. https://doi.org/10.1111/j.1365-2796.2010.02218.x
10 Cain, D. W., & Cidlowski, J. A. (2015). Specificity and sensitivity of glucocorticoid signaling in health and disease. Best practice & research. Clinical endocrinology & metabolism, 29(4), 545–556. https://doi.org/10.1016/j.beem.2015.04.007
11 Pruimboom, L., Ruiz-Núñez, B., Raison, C. L., & Muskiet, F. A. (2016). Influence of a 10-Day Mimic of Our Ancient Lifestyle on Anthropometrics and Parameters of Metabolism and Inflammation: The “Study of Origin”. BioMed research international, 2016, 6935123. https://doi.org/10.1155/2016/6935123
12 Sifakis, E. G., Lambrou, G. I., Prentza, A., Vlahopoulos, S., Koutsouris, D., Tzortzatou-Stathopoulou, F., & Chatziioannou, A. A. (2011). Elucidating the identity of resistance mechanisms to prednisolone exposure in acute lymphoblastic leukemia cells through transcriptomic analysis: A computational approach. Journal of clinical bioinformatics, 1, 36. https://doi.org/10.1186/2043-9113-1-36
13 Juster, R. P., Bizik, G., Picard, M., Arsenault-Lapierre, G., Sindi, S., Trepanier, L., Marin, M. F., Wan, N., Sekerovic, Z., Lord, C., Fiocco, A. J., Plusquellec, P., McEwen, B. S., & Lupien, S. J. (2011). A transdisciplinary perspective of chronic stress in relation to psychopathology throughout life span development. Development and psychopathology, 23(3), 725–776. https://doi.org/10.1017/S0954579411000289





